Grundlagenforschung für die Energiewende
Die Grundlagenforschung an unserem Institut schafft ein umfassendes Verständnis der Wirkungsweise aktiver Zentren von Katalysatoren, die wesentlich für die Umwandlungsprozesse von Energie und chemischen Bindungen sind. Dabei folgen wir dem Grundsatz von Max Planck "Dem Anwenden muss das Erkennen vorausgehen."
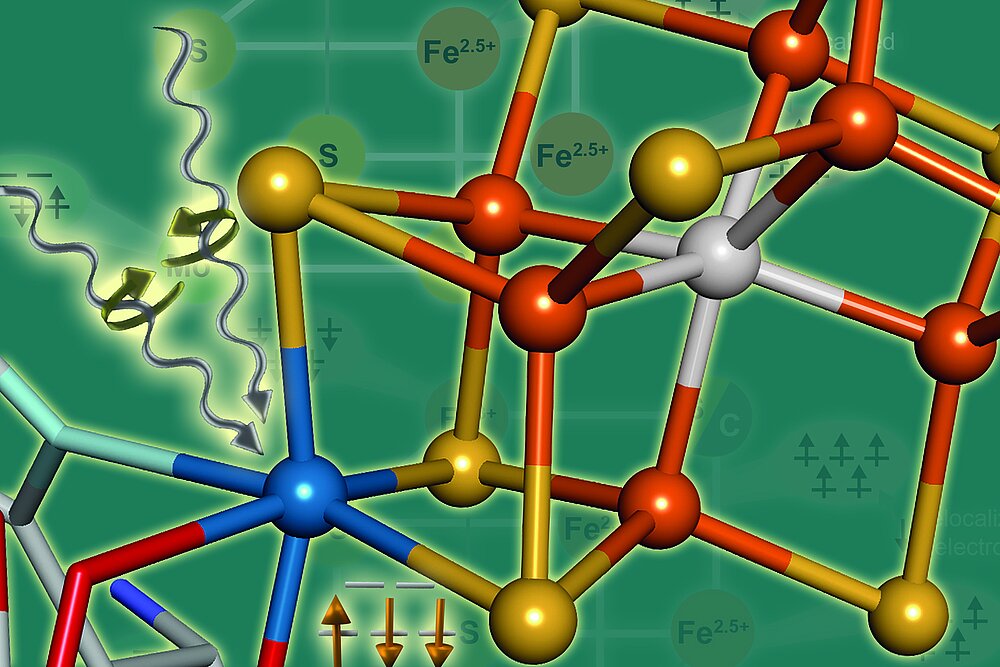
Anorganische Spektroskopie
Prof. Serena DeBeer
Molekulare Katalyse
Prof. Walter Leitner
Elektrosynthese
Prof. Siegfried R. Waldvogel
Heterogene Reaktionen
Prof. Robert Schlögl (Emeritus)
Aktuelles
Forschung
Am MPI CEC forschen Abteilungen, Max-Planck-Forschungsgruppen, Max Planck Fellows, Wissenschaftliche Servicegruppen und Mitarbeiter*innen des Joint Workspace Hand in Hand, um gemeinsam ausgewählte chemische Reaktionen so zu verstehen, dass sie uns zu einem „entfossilisierten“ Energiesystem führen. Forschung
Forschungsschwerpunkt: Wasserstoff
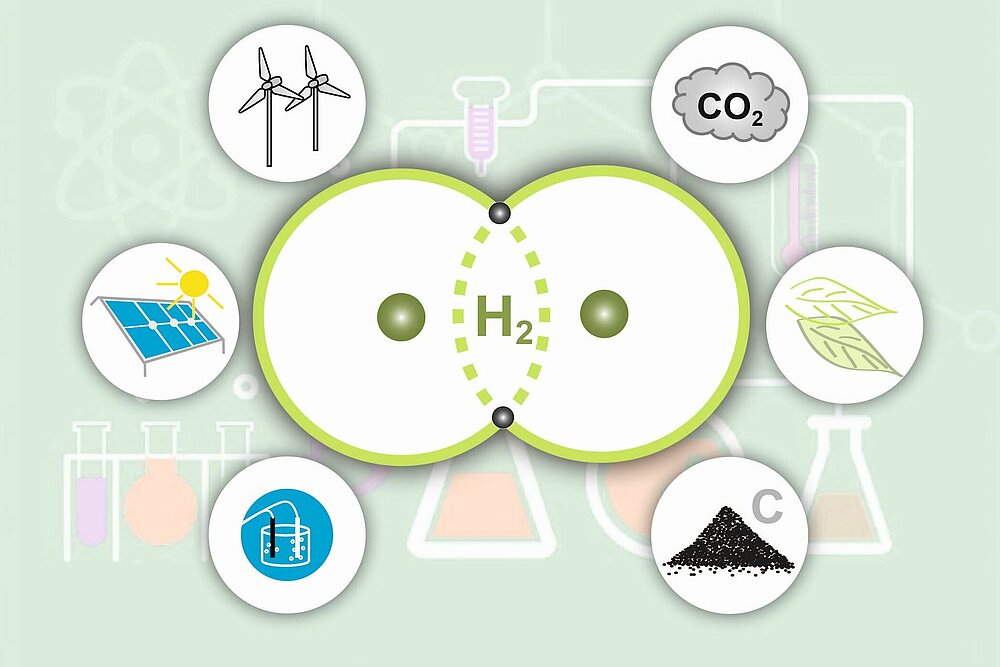
Wasserstoff (H2) spielt bei der Energiewende eine bedeutende Rolle und ist enorm wichtig für die angestrebte Dekarbonisierung aller Sektoren. Das MPI CEC erforscht das Potential des Wasserstoffs, seine Herstellung ebenso wie seine Speicher- und Nutzungsmöglichkeiten.
Nachwuchsforschungsgruppen
Max-Planck-Forschungsgruppen sind hervorragende Qualifizierungsmöglichkeit für promovierte junge Nachwuchswissenschaftler*innen, die innerhalb des Instituts einen selbstständigen Status genießen. Am MPI CEC gibt es derzeit vier Max-Planck-Forschungsgruppenleiter: Dr. Viktor Čolić und Prof. Dr. Thomas Wiegand.
Publikationen



Eine laufend aktualisierte Liste aller Publikationen aus dem MPI CEC ab 2012 finden Sie unter alle Publikationen