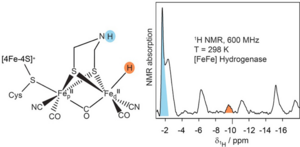
Die [FeFe] Hydrogenasen sind bisher als die effizientesten Katalysatoren für die H2-Produktion bekannt. Im aktuellen Arbeitsmodell dieses Prozesses wurde das Hydrid-Zustandszwischenprodukt als entscheidender Schritt bei der H2-Umwandlung erkannt. Das Auftreten dieses Zwischenprodukts ist jedoch unter (fast) physiologischen Bedingungen ohne direkten experimentellen Nachweis geblieben. Wissenschaftler des Max-Planck-Instituts für chemische Energiekonversion, in Zusammenarbeit mit der NMR-Gruppe des benachbarten Max-Planck-Instituts für Kohleforschung in Mülheim an der Ruhr, haben einen direkten Nachweis eines Hydridzwischenprodukts der [FeFe]-Hydrogenase bei Umgebungsbedingungen erbracht.
1H-NMR-Experimente wurden an gereiften Modellkomplexen des Zwischenzustandes, entweder in unmarkierter oder/und deuterierter Form, sowie an Wildtyp[FeFe] Hydrogenase durchgeführt. Ein klares Signal bei etwa -9,6 ppm wurde in den Spektren der nicht vollständig deuterierten Proben beobachtet und zusammen mit dem Spektrenvergleich der Modellkomplexe einem lösungsmittelaustauschbaren 1H (terminales Hydrid) zugeordnet.
In dieser Studie wurde erstmals die Möglichkeit gezeigt, mit Hilfe der NMR-Spektroskopie ein labiles Hydrid-Zwischenprodukt eines Enzyms in Lösung bei Raumtemperatur nachzuweisen. Dies eröffnet eine neue Perspektive für die Untersuchung des katalytischen Mechanismus von z.B. [FeFe] Hydrogenase.
Diese Gemeinschaftsarbeit aus den Forschungen des Mülheimer Chemie-Campus wurde kürzlich im <link https: pubs.acs.org doi abs jacs.8b00459 external-link-new-window internal link in current>Journal of American Chemical Society veröffentlicht.